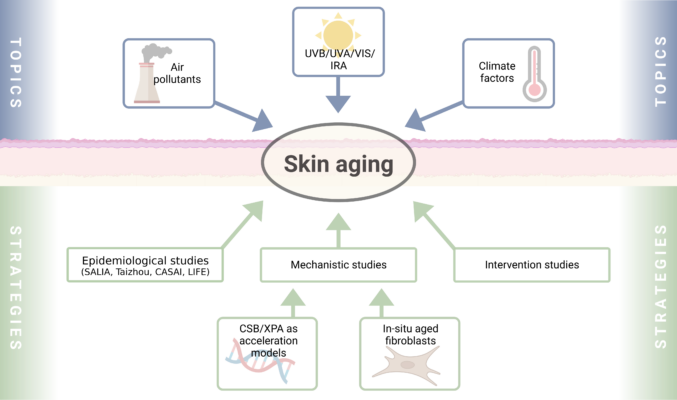
Die Arbeitsgruppe Krutmann erforscht die molekularen Mechanismen, die der umweltbedingten Hautalterung und den damit verbundenen Hauterkrankungen zugrunde liegen. Zu den wichtigsten Entdeckungen gehören: (1) die Beobachtung, dass der AHR maßgeblich an der UVB-Stressreaktion beteiligt ist; (2) ein potentiell kurativer Therapieansatz für das UV-empfindliche progeroide Cockayne-Syndrom; (3) die Identifizierung von verkehrsbedingter Luftverschmutzung als ursächlicher Faktor für Hautalterung/Pigmentierung; (4) die Identifizierung von Nahinfrarotstrahlen als ursächlich für die Hautfaltenbildung; (5) die Definition und Charakterisierung des Hautalterungsexposoms; (6) zusammen mit Klaus Unfried die Entwicklung eines ektoinbasierten Medizinproduktes zum Schutz vor partikelinduzierten Lungenerkrankungen; (7) die Identifizierung von zwei Cutotypen im Hautmikrobiom von Han-Chinesen. J. Krutmann hat regelmäßig strukturierte Forschungskonsortien wie das Graduiertenkolleg 1033, den SFB 728 und das LRA Healthy Ageing koordiniert. Derzeit ist er Sprecher des DFG FOR 5489.

Arbeitsgruppenleiter:
Jean Krutmann
Mehr als nukleäre DNA-Schädigung – Die Rolle von Mitochondrien und metabolischen Veränderungen bei den Nukleotid Exzisionsreparatur-Erkrankungen Xeroderma pigmentosum und Cockayne Syndrom
Im Rahmen dieses Projektes versuchen wir, neuartige molekulare Mechanismen zu identifizieren, die zu den UV-Hypersensitivität- und DNA Reparatur-Defizienz-assoziierten Krankheiten Xeroderma pigmentosum (XP) und Cockayne Syndrom (CS) beitragen, wobei eine besondere Betonung auf der Beteiligung der Mitochondrien liegt. Wir konnten zuvor zeigen, dass das CSB-Protein am Centrosom lokalisiert ist und dort mit Proteinen interagiert, die an der Acetylierung von α-Tubulin beteiligt sind, wodurch es die Autophagie stimuliert und auf diese Weise dem Verlust des subkutanen Fettgewebes, einem charakteristischen Symptom bei CS, entgegenwirkt. Basierend auf diesen Befunden haben wir eine pharmakologische Strategie entwickelt, mit der wir das subkutane Fettgewebe in einem CS-Mausmodell schützen konnten. Bezüglich XP zeigen neue Befunde unseres Labors, dass das Xeroderma pigmentosum Typ A (XPA)-Protein sich in den Mitochondrien befindet und dass sein Verlust den zellulären Energiestoffwechsel und epigenetische Regulationsprozesse beeinträchtigt. Derzeit untersuchen wir die Funktion des mitochondriellen XPA-Proteins sowie die molekularen Mechanismen, die zu der metabolischen und epigenetischen Dysregulation führen. Da beide Krankheiten, CS und XPA, nicht nur Hautsymptome, sondern auch einen schwerwiegenden degenerativen Gehirn-Phänotyp aufweisen, entwickeln und charakterisieren wir zurzeit in Zusammenarbeit mit der Core Unit GEMD humane Hirn- und Haut-Organoide, die aus iPS-Zellen mit Krankheits-assoziierten Mutationen generiert werden.
Kontrolle der kutanen Homöostase durch Keratinozyten mittels der UVB-induzierbaren Transkriptionsfaktoren HIF-1a und AHR
UVB-Strahlung als wichtiger Umweltfaktor löst DNA-Schäden aus. Anpassungsmechanismen der Haut gegenüber UVB beinhalten Bräunungsreaktion und Akanthose. UVB-induzierte Immunsuppression lindert häufig chronisch-entzündliche Hauterkrankungen, aber erhöht zugleich das Hautkrebsrisiko. Epidermale Keratinozyten interagieren mit umliegenden Zelltypen wie Melanozyten, Langerhanszellen und T-Zellen. Die Transkriptionsfaktoren HIF1a (Hypoxie-induzierter Faktor 1a) und AHR (Arylhydrocarbon-Rezeptor) sind beide in Keratinozyten UVB-responsiv und agieren somit als Umweltsensoren. Sie teilen sich denselben Co-Faktor und durch verschiedene Zielgene modulieren beide Immunantworten und Reparaturprozesse nach UVB-Bestrahlung. Dennoch ist ihre Interaktion kaum erforscht. Wir untersuchen die kombinierte Funktion von HIF-1a und AhR in Keratinozyten für die Haut-Homöostase sowie während Immunantworten mittels gentechnisch modifizierter in vivo-Modellen sowie Crispr/CAS9-mutierten Zell-Linien. Vorbefunde zeigen, dass die Haut von Mäusen mit HIF-1a-AHR-doppel-defizienten Keratinozyten phänotypisch UVB-bestrahlten (Wildtyp) Tieren ähnelt. Dies wirft die Frage auf, ob solche Haut einen vorbestehenden, verbesserten Schutz gegenüber UVB-Strahlung aufweist oder in einem Status von konstant erhöhtem Stress steht. Auch prüfen wir, ob deren kutane Immunabwehr in ähnlicher Weise gestört ist wie unter UVB-induzierter Immunsuppression des Wildtyps und wollen zugrundeliegende intrazelluläre Prozesse identifizieren. Diese Fragen werden mittels folgender Ansätze adressiert: Haut-Einzelzell-Transkriptom-Analysen, in vivo-Immunaktivierung sowie Zellkulturversuche. In diesem Projekt kooperieren wir eng mit den AGs Esser, Haarmann-Stemmann und der zentralen Core Unit GEMD. Das Projekt wird von der DFG gefördert (DFG-Projekt FA1468/2-2, Folgefinanzierung zu FA1468/2-1).
DFG FOR5489: Teilprojekt 6 - Crosstalk between AHR signaling and retinoids in skin
Aryl hydrocarbon receptor (AHR) signaling is critical for skin barrier and photocarcinogenesis - both is also affected by retinoids (vitamin A derivatives). Their most relevant bioactive form in the skin is all-trans retinoic acid (atRA). atRA is metabolized from retinal by aldehyde dehydrogenase 1A enzymes. Besides endogenous atRA metabolism in keratinocytes, synthetic retinoids are being applied topically for therapeutic/cosmetic indications. There is compelling evidence from other tissues, that retinoid signaling and AHR signaling can influence each other after application of the permanent AHR activation dioxin (TCDD). It is currently not known how transient activation by clinically relevant AHR ligands affects retinoid metabolism, how retinoids impact AHR signaling caused by such ligands, and how these interactions might be relevant for skin. We observed that AHR signaling regulates atRA synthesis in human keratinocytes and murine skin and that a presumably AHR-dependent aldehyde dehydrogenase 1A isoform may be critically involved in this context. In addition, independent evidence suggests that a combined treatment of murine skin with atRA plus TCDD caused a proinflammatory, psoriasis-like skin response. We therefore hypothesize that in skin, AHR signaling and retinoid signaling influence each other, that this interaction is bidirectional and of clinical relevance, e.g. for skin barrier function. Specifically, we will assess AHR ligand-mediated regulation of atRA synthesis in keratinocytes, the role of the putatively AHR-dependent aldehyde dehydrogenase 1A isoform, and the relevance of endogenous retinoid synthesis as an integral part of AHR responses in keratinocytes. Further, we will assess the mechanistic crosstalk and functional outcome of exogenously added atRA and AHR ligands in skin. We will address these topics by employing different in vitro and in vivo approaches, modern genome engineering methods and bioinformatic analysis of big systemic data sets. In the context of this project as a part of the DFG research unit “Understanding aryl hydrocarbon receptor signaling in skin disorders”, we cooperate with numerous internal and external project partners.
DFG Graduiertenkolleg (GRK) 2624 : Biostatistische Methoden für hochdimensionale Daten in der Toxikologie
Das Graduiertenkolleg 2624 wird von der DFG gefördert und läuft in der ersten Phase von 04/2021 bis 09/2025. Beteiligte Einrichtungen sind neben dem IUF die Heinrich-Heine-Universität Düsseldorf, die Technische Universität (TU) Dortmund und das IfADo – Leibniz-Institut für Arbeitsforschung an der TU Dortmund. Das Ziel des Graduiertenkollegs ist die Entwicklung und Anwendung biostatistischer Methoden zur Analyse hochdimensionaler Daten für die Modellierung und Risikobewertung in der Toxikologie. Die Promovierenden erwerben Kenntnisse in der Toxikologie und die Fähigkeit, statistische Methoden für Fragestellungen in der Pharmakologie und Umwelttoxikologie zu entwickeln und anzuwenden. In der Toxikologie werden innovative statistische Methoden benötigt, um die ständig wachsende, heterogene, molekulare Datenmenge für eine adäquate Modellierung und Risikovorhersage optimal zu nutzen. Neben den herkömmlichen eindimensionalen Dosis-Wirkungs-Modellen müssen daher komplexere Modelle entwickelt werden. Hochdimensionale Omics-Daten werden in der Modellierung sowohl als Interaktionsfaktor für die toxikologische Exposition, als auch als Zielgröße verwendet.
Novel health care strategies for melanoma in children, adolescents and young adults (MELCAYA)
Bei Kindern, Jugendlichen und jungen Erwachsenen (CAYAs) ist das Melanom noch nicht ausreichend erforscht, und das Fehlen maßgeschneiderter klinischer Leitlinien und standardisierter Ansätze führen zu einer sehr geringen diagnostischen Genauigkeit. Das MELCAYA-Projekt zielt darauf ab, die Risikofaktoren und Determinanten des Melanoms zu verstehen, um die Prävention, Diagnose und Prognose von Melanomen in CAYAs zu verbessern. Die AG Krutmann trägt zusammen mit der AG Schikowski zur Identifizierung von Risikofaktoren, Exposomik und genetischer Anfälligkeit für Melanome bei CAYAs bei. Die Förderung des Projektes erfolgt im Rahmen des Förderprogramms HORIZON-MISS-2021- Cancer-02-03 (2022-2028).
Taizhou Projekt (China)
Das Projekt „Air pollution exposure, its interaction with genes and the role of systemic inflammation on skin-related outcomes in an elderly Chinese population“ ist eine Zusammenarbeit mit der Max Planck-CAS Paul Gerson Unna Research Group on Dermatogenomics in Shanghai, China (Kooperationspartner: Dr. Sijia Wang) und der Fudan Universität, China. Die Studie untersucht die langfristigen Auswirkungen der Luftverschmutzung auf die Haut, Lunge und Gehirn in der chinesischen Bevölkerung. Der Schwerpunkt liegt auf den Wechselwirkungen zwischen Genen und Luftverschmutzung, um mögliche vulnerable Gruppen zu identifizieren, und zusätzlich auf systemischen Entzündungen. Dieses Projekt findet in enger Zusammenarbeit mit der AG Schikowski statt. Die externen Kooperationspartner sind Prof. Li Jin, Prof. Theresa Wang und Prof. Haidong Kan (Fudan Universität, Shanghai, China). Das Projekt wird durch das Joint IUF-PICB Research Project sowie durch Industriemittel gefördert.
CASAI Kohorte (India)
Das Projekt „Climate, air pollution and skin aging in Indian women (CASAI)“ ist eine Zusammenarbeit mit dem Centre for Environmental Science and Engineering, Indian Institute of Technology (IIT) Bombay, Mumbai, Indien (Kooperationspartner: Prof. Harish Phuleria). Die Studie untersucht die langfristigen Auswirkungen der Klima- und Luftverschmutzungsexposition auf extrinsische Hautalterung bei indischen Frauen im Alter von über 20 Jahren. Die Studie konzentriert sich auf die Wechselwirkung von Klima und Luftverschmutzung, die als wichtige Umweltfaktoren für die Entstehung vorzeitiger Hautalterungserscheinungen identifiziert worden sind. Indien mit seinen vielfältigen klimatischen Bedingungen, extremen Temperaturen und hoher Luftschadstoffbelastung bietet die Möglichkeit, extrinsische Hautalterungszeichen in einer Bevölkerung zu entdecken, die sich ethnisch und sozioökonomisch von westlichen und anderen asiatischen Ländern unterscheidet. Die Kohorte wurde in den Jahren 2018-2020 in drei großen indischen Großstädten durchgeführt: Delhi, Mumbai und Bangalore, und untersuchte 1 500 Teilnehmerinnen in der Basisuntersuchung. Dieses Projekt wird in enger Zusammenarbeit mit der AG Schikowski durchgeführt und mit Mitteln von Amway unterstützt.
IUF-intern:
AG Esser
AG Koch
AG Schikowski
AG Schins
AG von Mikecz
AG Haarmann-Stemmann
AG Ventura
LG Weighardt
Core Unit GEMD (Rossi)
National:
Prof. Bernhard Homey, Klinik für Dermatologie, Universitätsklinikum Düsseldorf
Prof. Karin Loser, Institut für Immunologie, Carl von Ossietzky Universität Oldenburg
Priv.-Doz. Dr. Stephan Meller, Klinik für Dermatologie, Universitätsklinikum Düsseldorf
Prof. Sven Meuth, Klinik für Neurologie, Universitätsklinikum Düsseldorf
Prof. Thomas Tüting, Universitätshautklinik Magdeburg, Otto-von-Guericke-Universität Magdeburg
International:
Prof. Jean-Marc Egly, University of Strasbourg, Frankreich
Prof. Akimichi Morita, Nagoya City University, Nagoya, Japan
Prof. Thierry Passeron, Côte d'Azur University, Centre Hospitalier Universitaire de Nice, Department of Dermatology, Frankreich
Prof. Henry Lim, Department of Dermatology, Henry Ford Health, Detroit, Michigan, USA
Prof. Jiucun Wang, Fudan University, Department of Anthropology and Human Genetics, Shanghai, China
Prof. Sijia Wang, PICB, Shanghai, China
Die AG Krutmann betreut innerhalb des IUF gemeinsam mit S. Grether-Beck die „Human in vivo studies“.
Promovierende
Technische Assistenz
- Selina Dangeleit, BTA
- Maren Knechten, BTA
- Elisabeth Springer, BTA
- Ingo Uthe, BTA



