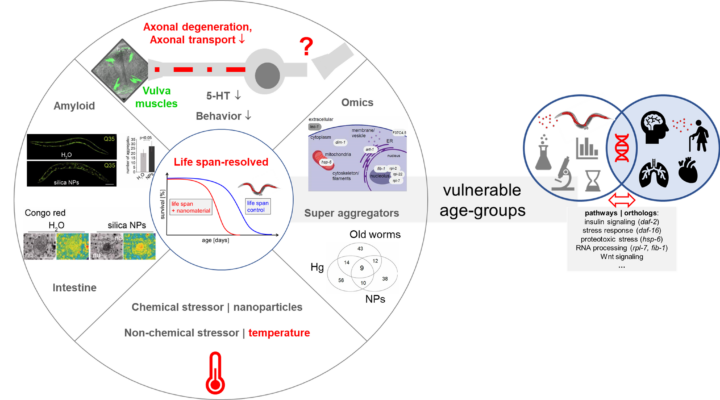
Die Arbeitsgruppe von Mikecz untersucht die Wirkung von Schadstoffen auf die Funktion des Zellkerns, die Genexpression. Eine wichtige Rolle spielt hierbei das nucleäre Ubiquitin-Proteasomen-System, das für die Qualitätskontrolle und einen ausgeglichenen Proteinhaushalt (Homeostase) sorgt. Die AG hat dazu beigetragen das Ubiquitin-Proteasomen-System im Zellkern zu charakterisieren und dessen Rolle bei nucleären Prozessen wie der Transkription aufzuklären. Es konnte gezeigt werden, dass einige Schwermetalle und Nanomaterialien den proteasomalen Proteinabbau stören und es zur Bildung von Amyloid-ähnlichen Aggregaten im Zellkern kommt. Diese Aggregate stellen proteolytische Zentren dar, die bei einer Schadstoff-induzierten Stressantwort u. a. Komponenten des Ubiquitin-Proteasomen Systems, Heat Schock Proteine und Faktoren der RNA-Prozessierung rekrutieren. Die Schadstoff-induzierten Amyloid-ähnlichen Aggregate im Zellkern weisen eine auffällige Übereinstimmung mit neuronalen nucleären Einschlüssen auf, die bei neurodegenerativen Aggregaterkrankungen vorkommen. Die Untersuchung der Mechanismen der amyloiden Proteinaggregation dient damit sowohl dem besseren Verständnis der molekularen Wirkungen von Schadstoffen, sowie der Mechanismen von neurodegenerativen Aggregaterkrankungen. So zeigte die AG von Mikecz im Fadenwurm C. elegans, dass Nanopartikel aus Siliziumdioxid oder anorganisches Quecksilber amyloide Proteinaggregation in neuronalen Zellen auslösen, die die serotonerge Signalübertragung beeinträchtigt. Diese Neurotoxizität manifestiert sich in C. elegans durch die Störung von neuromuskulären Verhaltensphänotypen, die ansonsten typisch für alternde Fadenwürmer sind.
Schadstoffe wie bestimmte Nanomaterialien und Schwermetalle stören den Proteinhaushalt im Zellkern und befördern die Bildung von Amyloid-ähnlichen Proteinaggregaten, Neurodegeneration und vorzeitige Alterungsprozesse.

Arbeitsgruppenleiterin:
Anna von Mikecz
In den folgenden Projekten werden die biologischen Vorgänge untersucht, die eine solche Störung der Qualitätskontrolle im Zellkern verursachen:
Projekt 1
In dem Projekt ‚Nanotoxikologie über die gesamte Lebensspanne: das Nervensystem als Zielorgan und vulnerable Altersgruppen im Nematoden Caenorhabditis elegans‘ werden die Interaktionen von Nanomaterialien mit neuronalen Zellen im Tiermodell C. elegans untersucht. Die kontinuierlich wachsende Anwendung von anthropogenen Nanomaterialien und deren Freisetzung in der Umwelt, aber auch die zunehmende Verwendung von Nanopartikeln als Zusatzstoffe in Nahrungsmitteln erfordern eine Erforschung relevanter Expositionsszenarien. Die AG von Mikecz führt daher Langzeituntersuchungen durch, d. h. die Untersuchungen zur Nanotoxikologie im Fadenwurm erstrecken sich über dessen gesamte Lebensspanne ('whole-life nanotoxicology'). Das Nervensystem des Fadenwurms stellt dabei ein besonders sensitives Zielorgan für negative Effekte von Nanomaterialien dar. Nanopartikel aus Siliciumdioxid (Nano-Silika) induzieren eine weitverbreitete Proteinaggregation, die auch die Axone einzelner serotonerger Neurone betrifft. Die Neurone degenerieren, die serotonerge Neurotransmission ist beeinträchtigt und es kommt zu Defekten von neuromuskulären Verhaltensphänotypen, wie der Eiablage und der Vorwärtsbewegung. Diese Defekte treten normalerweise erst bei mittelalten oder alten C. elegans auf. Deshalb manifestiert sich die Toxizität bestimmter Nanomaterialen offenbar in einer reduzierten Gesundheitsspanne der Fadenwürmer, der eine Proteinaggregation und die Degeneration wichtiger Neurone vorangeht. Alle Analysen erfolgen über die gesamte Lebensspanne von C. elegans vom jungen bis zum alten Wurm. Dabei wird im Detail untersucht, welche zeitlichen Beziehungen zwischen der beobachteten Neurodegeneration und den Verhaltensdefekten bestehen. Durch die Analysen über die gesamte Lebensspanne können Altersgruppen der Fadenwürmer identifiziert werden, die besonders sensitiv, d. h. vulnerabel für bestimmte Nanomaterialien sind. Die Genexpression in den vulnerablen Altersgruppen wird mittels transkriptomischen und proteomischen Hochdurchsatzmethoden charakterisiert. Ziel ist die Identifikation der zellulären Signalwege, die von Nanomaterialen beeinflusst werden. Gibt es Signalwege, die bei den vulnerablen Gruppen spezifisch gestört sind? In dem Projekt wird ein kostengünstiges und zuverlässiges Screening von verschiedenen Nanomaterialien entwickelt, das die Nanopartikel identifizieren soll, die nicht zu Defekten des Nervensystems führen ('neurosafe nanomaterials'). Das Projekt wird von der Deutschen Forschungsgemeinschaft und der Graduiertenschule iBRAIN (HHU) gefördert.
Projekt 2
In einem IUF Brückenprojekt werden die Effekte von Luftschadstoffen im Modell C. elegans und in humanen Kohorten untersucht. Partikuläre Luftschadstoffe sind eine Gefahr für die menschliche Gesundheit. Insbesondere Nanopartikel kommen in der Stadtluft häufig vor, haben die Eigenschaft bis in nahezu alle Organe vorzudringen und besitzen eine hohe Bioreaktivität. Es gibt Evidenz sowohl von mechanistischen Untersuchungen, als auch epidemiologischen Studien, dass Nanopartikel die Neurokognition beeinflussen können. So konnte in den letzten Jahren gezeigt werden, dass die Exposition mit Luftschadstoffen aus dem Straßenverkehr durch vaskuläre und entzündliche Prozesse schädliche Auswirkungen auf das Gehirn und entsprechende kognitive Fähigkeiten hat. Im Fall der neurodegenerativen Erkrankung Alzheimer sind weniger als 5% der Fälle auf eine genetische Komponente zurückzuführen was bedeutet, dass Umweltfaktoren, wie Luftverschmutzung, eine Rolle bei der Entstehung und Beförderung der Krankheit spielen könnten. Auch der Morbus Parkinson wurde mit verschiedenen Umweltschadstoffen in Verbindung gebracht. Daher werden im Projekt die neurobiologische Wirkung von Nanopartikeln in Luftschadstoffen im Tiermodell C. elegans und in epidemiologischen Kohortenstudien untersucht. In C. elegans werden hierfür Alzheimer und Parkinson Tiermodelle mit Nanopartikeln belastet, die entweder bei der Verbrennung von fossilen Kraftstoffen oder durch Reifenabrieb entstehen. Das Nervensystem der Nematoden wird über die gesamte Lebensspanne auf neurodegenerative Prozesse und Funktionsverlust der Neurotransmission untersucht. Das Projekt wird in Teilen von der Alzheimer Initiative finanziert.
Projekt 3
Aufgrund der exponentiell wachsenden Anwendung und Produktion von Nanomaterialien und deren absehbarer Verbreitung in der Umwelt ergibt sich die Notwendigkeit, die Bioverfügbarkeit von Nanopartikeln und deren Exposition in Wildtieren besser zu verstehen. In einem ökonanotoxikologischen Projekt testen wir die Hypothese, dass spezifische Eigenschaften von Nanomaterialien signifikante biologische Effekte in freilebenden Nematoden auslösen. Die Analyse von Effekten im Modellorganismus C. elegans und in aus der Umwelt isolierten Nematoden soll beantworten, ob verallgemeinerbare Mechanismen identifiziert werden können. Die Untersuchungen konzentrieren sich auf Nanopartikel, die durch ihre industrielle Anwendung und ihre Verbreitung in der Umwelt (z. B. Reifenabrieb) besonders relevant sind. Nematoden stehen dabei beispielhaft für freilebende Fadenwürmer, die in der in der Flüssig- zu Festphase von unversiegelten Böden leben. In C. elegans werden Parameter wie die Lebensspanne, die Reproduktion und die Alters-assoziierte Proteinhomeostase untersucht. Außerdem wird die Technik der Einzelwurm Proteomik entwickelt um die Genexpression in ‚Labor‘ C. elegans und wilden Nematoden zu vergleichen (Mikecz and Scharf, Nature 2022). Ein spezifisches Ziel ist die Translation der Ergebnisse vom Tiermodell C. elegans zu Nematoden, die aus der Umwelt isoliert wurden, d.h. die Identifizierung von gemeinsamen Mechanismen. Das Projekt wird von der Washington University in St. Louis, USA, dem Department Biologie der HHU und der DFG gefördert.
IUF-intern:
Team Unfried
AG Schikowski
AG Schins
LG Ventura
National:
HHU, Graduiertenschule iBRAIN Neuroscience Network Düsseldorf
FLI, Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut e.V., Jena, AG Hemmerich
INM, Leibniz-Institut für Neue Materialien, Saarbrücken, AG Kraegeloh
DKNR, Deutsches Kompetenznetzwerk Rheumatologie
DNSS, Deutsche Netzwerk für Systemische Sklerodermie
International:
ISH, International Society for Histochemistry
BWCN, International Committee of the Bernhard Workshop on the Cell Nucleus
EU, EU NanoSafetyCluster
Washington University, St. Louis, USA



